Wussten Sie, dass etwa 1 von 5 Krebspatienten eine Resistenz gegen Standardbehandlungen entwickelt? Dies unterstreicht den dringenden Bedarf an wirksamen Zusatztherapien. Thymoquinon, eine Verbindung aus Nigella sativa, hat sich in diesem Bereich als potenzieller Wendepunkt herauskristallisiert. Seine Fähigkeit, Apoptose zu induzieren und die Effekte der Chemotherapie zu verstärken, wirft interessante Fragen zu seiner Rolle in der Krebstherapie auf. Was könnte das für zukünftige Behandlungsprotokolle bedeuten?
Übersicht über Thymoquinon und seine Eigenschaften
Thymoquinon (TQ), eine kraftvolle Verbindung, die aus Nigella sativa extrahiert wird, verfügt über eine Reihe von bioaktiven Eigenschaften, die es zu einem interessanten Thema in der Krebsforschung machen. Seine entzündungshemmende und Antikrebswirkung wurden besonders in Studien zu Tumorzellen hervorgehoben. TQ steigert nicht nur die Wirksamkeit der Chemotherapie, sondern minimiert auch die Nebenwirkungen, was es zu einer vielversprechenden Begleittherapie macht. Forschungsergebnisse zeigen, dass TQ einen Zellzyklus-Arrest induzieren und Apoptose in Krebszellen fördern kann, während normale Zellen verschont bleiben. Darüber hinaus hemmt TQ die Hypermethylierung von Tumorsuppressorgenen, was zur Hochregulierung essenzieller Proteine führt, die bei der Krebsunterdrückung helfen. Mit seinen vielfältigen bioaktiven Komponenten hebt sich TQ als potenzieller Wendepunkt in der Krebsforschung hervor, insbesondere bei Darmkrebs.
Mechanismen der Wirkung in der Krebsforschung
Während Sie die Wirkmechanismen in der Krebsforschung untersuchen, werden Sie feststellen, dass Thymoquinon (TQ) eine wesentliche Rolle bei der Modulation des Zellverhaltens spielt. TQ induziert Zellzyklusarrest in Tumorzellen, insbesondere in den G1/S- und G2/M-Phasen, was die Zellproliferation und das Tumorwachstum reduziert. Durch die Förderung von Apoptose und Nekroptose erhöht TQ die Zytotoxizität durch kritische Signalwege wie PI3K/Akt/mTOR und NF-κB. Wichtig ist, dass TQ signifikante zytotoxische Effekte gegen kolorektale Krebszelllinien zeigt, mit einem IC50 von 0,284 mM für HT-29-Zellen. Es hemmt auch die Hypermethylierung von Tumorsuppressorgenen, was zur Hochregulierung von SHP-1 und SOCS-3 führt. Darüber hinaus verbessert TQ die Wirksamkeit von chemotherapeutischen Agenzien und zeigt sein Potenzial als selektive therapeutische Wirkung in Krebsbehandlungsstrategien.
Thymoquinons Wirkung auf Darmkrebszellen
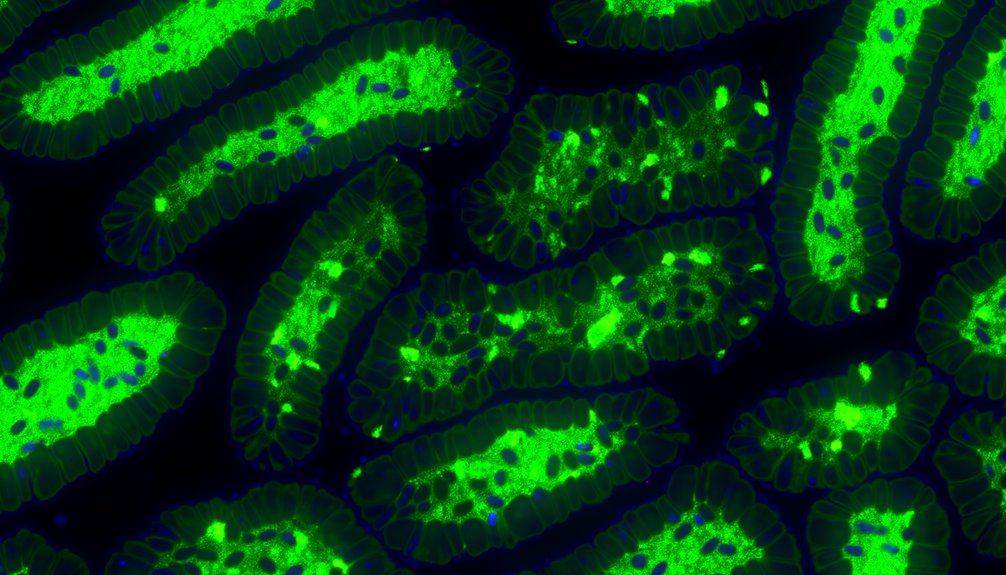
Obwohl viele Verbindungen auf ihre krebsvorbeugenden Eigenschaften untersucht werden, sticht Thymoquinon (TQ) durch seine starken Effekte auf kolorektale Krebszellen (CRC) hervor. TQ zeigt signifikante zytotoxische Effekte, insbesondere auf die Caco-2-Zelllinie, mit einem IC50 von 0,284 mM, während normale Zellen verschont bleiben. Es induziert Zellzyklusarrest in den Phasen G1/S und G2/M und fördert Apoptose und Nekroptose durch Modulation von Signalwegen wie PI3K/Akt/mTOR und NF-κB. Zusätzlich verbessert TQ die Wirksamkeit von 5-Fluorouracil (5-FU), indem es dessen pharmakokinetisches Profil verbessert und letztlich die Chemosensitivität steigert. Darüber hinaus reduziert TQ die Krebsstammigkeit und verstärkt die Effekte von Cisplatin und ionisierender Strahlung, was zur verstärkten Zytotoxizität in CRC-Behandlungsprotokollen beiträgt.
Kombinationstherapien unter Einbeziehung von Thymoquinon
Die Kombination von Thymoquinon mit konventionellen Chemotherapie-Agenten hat vielversprechende Ergebnisse bei der Verbesserung der Wirksamkeit der Krebsbehandlung gezeigt, insbesondere bei kolorektalem Krebs (CRC). Thymoquinon zeigt synergistische Effekte, wenn es mit 5-Fluorouracil kombiniert wird, wodurch dessen Zytotoxizität gegen Tumorzellen gesteigert und die erforderliche Medikamentendosis verringert wird. In vitro Studien heben hervor, dass TQ die Pharmakokinetik von 5-FU verbessert, indem es dessen Fläche unter der Kurve und maximale Konzentration erhöht. Darüber hinaus erhöht TQ die Aufnahme von Imatinib, indem es die Expression von ABCB1 und ABCG2 hemmt, was auf seine Rolle in zielgerichteten Therapien hindeutet. Kombinationstherapien mit TQ und ionisierender Strahlung zeigen ebenfalls verstärkte zytotoxische Effekte, die die Krebsstammzellen verringern. Insgesamt unterstützen diese Erkenntnisse das Potenzial von TQ als Adjunkttherapie in der Krebsforschung und weisen auf einen bedeutenden Fortschritt in den Behandlungsstrategien für CRC hin.
Zukünftige Richtungen in der Thymoquinon-Forschung
Da Forscher tiefer in das Potenzial von Thymoquinon (TQ) bei der Krebsbehandlung eintauchen, zielen sie darauf ab, seine molekularen Ziele und Wirkmechanismen in Krebszellen aufzudecken. Dies wird therapeutische Anwendungen optimieren und die Rolle von TQ in Kombinationstherapien verbessern, insbesondere bei Darmkrebs und anderen bösartigen Erkrankungen. Laufende Studien werden die Fähigkeit von TQ untersuchen, die Krebsstammzellbildung zu mindern, die Chemosensitivität zu verbessern und zu wirksameren Behandlungsprotokollen zu führen. Darüber hinaus könnte die Integration von TQ in neuartige Arzneimittelabgabesysteme, wie Nanopartikel, seine Bioverfügbarkeit und therapeutische Wirksamkeit gegen Tumore erheblich steigern. Zukünftige klinische Studien sind essentiell, um die Sicherheit und Wirksamkeit von TQ bei verschiedenen Krebsarten zu validieren, sein Potenzial als begleitende Therapie in der Onkologie zu erweitern und zur gesamten Krebsforschungslandschaft beizutragen.
Abschluss
Im Bereich der Krebsbehandlung erstrahlt Thymoquinon wie ein Hoffnungsschimmer, der Forscher zu neuen Horizonten führt. Stellen Sie sich einen Gärtner vor, der empfindliche Pflanzen pflegt; Thymoquinon stärkt nicht nur die Wurzeln der Krebstherapien, sondern hilft auch, die aggressiven Tumoren auszusortieren. Da Studien weiterhin sein Potenzial aufzeigen, könnte Thymoquinon zu einem wesentlichen Verbündeten im Kampf gegen Krebs werden und den Patienten einen helleren Weg zur Genesung und eine bessere Lebensqualität bieten.

